La eficacia y seguridad de Takhzyro (lanadelumab), unido a una cómoda posología y administración mediante jeringa precargada (2 ml cada dos semanas), supone un antes y un después en el tratamiento de los pacientes con angioedema hereditario (AEH). Este nuevo fármaco ha demostrado una eficacia del 87 por ciento en la reducción de ataques y con 8 de cada 10 pacientes (77 por ciento) experimentando cero ataques, lo que viene a significar una innovación con el potencial de mejorar notablemente la calidad de vida de los pacientes a corto plazo.
Takeda ha anunciado este lunes la comercialización en España de Takhzyro (lanadelumab), medicamento de prescripción inyectable subcutáneo aprobado en Europa para la prevención rutinaria de ataques recurrentes de angioedema hereditario (AEH) en pacientes de 12 años o más.
Takhzyro recibió la aprobación europea en noviembre de 2018 en base a los resultados del estudio fase 3 HELP (profilaxis hereditaria a largo plazo), que midió la reducción en el número de ataques de AEH mensuales medios en pacientes que recibieron tratamiento con Takhzyro frente a placebo.
“Desde Takeda estamos comprometidos con los pacientes y los profesionales sanitarios. Nuestro objetivo es innovar continuamente teniendo al paciente en el centro de nuestras decisiones. Estamos convencidos de que la aprobación de Takhzyro (Lanadelumab) en España supondrá un antes y un después en el tratamiento de los pacientes con angioedema hereditario. La eficacia, seguridad y comodidad de posología y administración del producto mediante el uso de jeringa precargada, tendrá el potencial de mejorar notablemente la calidad de vida de los pacientes” , ha indicado Carmen Montoto, directora médica, de regulatorio y calidad de Takeda España.
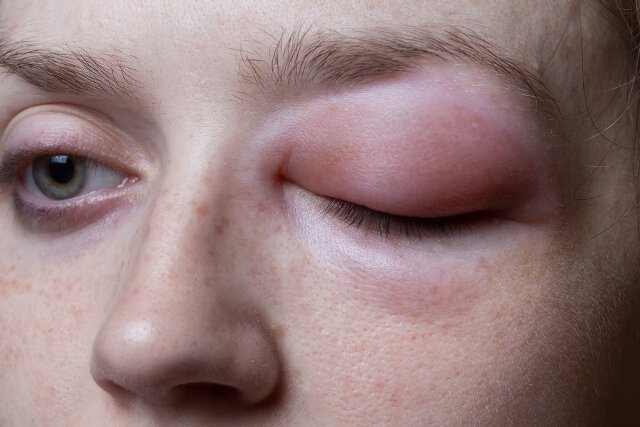
El AEH es un trastorno genético raro que causa crisis recurrentes de edema – hinchazón – en diversas partes del cuerpo, incluyendo el abdomen, la cara, los pies, los genitales, las manos y la garganta. El AEH afecta aproximadamente a 1 de cada 50.000 personas en todo el mundo.
Acerca de TAKHZYRO (lanadelumab)
TAKHZYRO (lanadelumab) está indicado para la prevención rutinaria de ataques recurrentes de AEH en pacientes de 12 años o más. TAKHZYRO es un anticuerpo monoclonal totalmente humano que se une específicamente a la calicreína plasmática y disminuye su actividad. TAKHZYRO se produce en células de ovario de hámster chino (CHO) mediante tecnología de ADN recombinante.
TAKHZYRO está formulado para administración subcutánea y tiene una vida media de 14 días. TAKHZYRO se ha formulado para la administración por el paciente o por un cuidador. El paciente o el cuidador deben recibir formación de un profesional sanitario.
TAKHZYRO no está destinado al tratamiento de ataques de AEH agudo.
Indicaciones locales e información de seguridad importante
Indicación e información importante de seguridad en la UE:
INDICACIÓN
TAKHZYRO (lanadelumab) está indicado como profilaxis para prevenir las crisis de angioedema hereditario (AEH) en pacientes de 12 años en adelante.
INFORMACIÓN IMPORTANTE SOBRE SEGURIDAD
Se han observado reacciones de hipersensibilidad. En caso de reacción de hipersensibilidad grave, se debe suspender la administración de TAKHZYRO e instaurar el tratamiento adecuado.
Reacciones adversas: Las reacciones adversas observadas con más frecuencia (≥ 10 % y más que con placebo) asociadas a TAKHZYRO fueron principalmente dolor, eritema y hematomas en el lugar de inyección, infección de las vías respiratorias altas, dolor de cabeza, exantema, mialgias, mareo y diarrea. La reacción adversa menos frecuente observada fue la elevación de las transaminasas; un paciente se retiró del ensayo por elevación de las transaminasas.
Uso en poblaciones específicas: No se han establecido la seguridad ni la eficacia de TAKHZYRO en pacientes pediátricos menores de 12 años.
No se dispone de datos sobre TAKHZYRO en mujeres embarazadas. No se dispone de datos sobre la presencia de lanadelumab en la leche humana ni sus efectos sobre los lactantes alimentados con lactancia materna.
Para audiencias de la UE, consulte la ficha técnica o resumen de las características del producto (RCP) de TAKHZYRO.
REFERENCIAS
- TAKHZYRO® (lanadelumab) European Union Ficha Técnica del producto.
- Banerji A, Riedl MA, Bernstein JA, et al.; para los Investigadores de AYUDA. Efecto de lanadelumab en comparación con placebo prevención de ataques de angioedema hereditario: un ensayo clínico aleatorizado. Jama. 2018;320(20):2108-2121.
- Cicardi M, Bork K, Caballero T, et al.; en nombre de HAWK (Grupo de Trabajo Internacional de Angioedema Hereditario).
- Evidencia recomendaciones basadas en el manejo terapéutico del angioedema debido al inhibidor hereditario de C1
- deficiencia: consenso informe de un Grupo de Trabajo Internacional. Alergia. 2012;67(2):147-57.
- Angioedema hereditario. N Engl J Med. 2008;359(10):1027-36.
- Banerji A. La carga de la enfermedad en pacientes con angioedema hereditario. Ann Alergia Asma Inmunol.
- 2013;111(5):329-36.
- Longhurst HJ, Bork K. Angioedema hereditario: causas, manifestaciones y tratamiento. H. J Hosp Med.
- 2006;67(12):654-7.
- TAKHZYRO® (lanadelumab) injection Prescribing Information.